脑病中心神经血管免疫团队9项研究成果在Brain&Brain PET年会展示
6月12日-15日,由国际脑血流和代谢学会(The International Society for Cerebral Blood Flow and Metabolism,ISCBFM)、地方组织委员会和项目委员会联合举办的“2023年国际定量脑功能会议(Brain & Brain PET 2023)”在澳大利亚布里斯班召开。会议就各类神经科学前沿研究,尤其是大脑功能、代谢和脑血流等领域进行交流探讨。来自中山大学附属第三医院精神与神经疾病研究中心(以下简称“脑病中心”)的神经血管及免疫团队在会上作9项最新研究成果分享,包括7项口头报告及2项壁报展览形式展览。其中,脑病中心研究生通过深入参与实验设计、数据分析和科研讨论,展现出了良好的创新思维、科研能力和独立思考能力,为团队的研究工作做出了重要贡献。
蔡蔚副研究员在大会上作题为“Multifaced Activities of Macrophage after Initiation of Phagocytosis in Cerebral Vascular Disorders”的专题报告,系统介绍了我院脑病中心神经血管免疫团队在相关领域的研究结果。巨噬细胞通过细胞吞噬作用在脑血管疾病中发挥重要功能。一方面,吞噬激活的巨噬细胞可释放炎性因子和趋化因子,吸引和激活其他免疫细胞,形成炎症病变区域;另一方面,巨噬细胞通过吞噬和消化病理性物质清除脑血管中的炎症和坏死细胞,起到保护神经元和脑组织的作用。此外,巨噬细胞还参与了血管重塑和修复过程,通过释放生长因子和细胞外基质分子,促进血管内皮细胞增殖和修复,有助于恢复脑血管的功能。

图1:蔡蔚副研究员作专题报告
神经内科沈施施博士后通过壁报展示了多发性硬化的相关研究成果。多发性硬化(Multiple Sclerosis,MS)是由免疫系统错误地攻击并损害神经元的髓鞘继而导致炎症和脱髓鞘的一种自身免疫性中枢神经系统疾病。近期研究表明巨噬细胞在MS中获得激活并参与炎性反应。脑病中心神经血管免疫团队发现,巨噬细胞胞外网捕(Macrophage Extracellular Traps,METs)通过破坏血脑屏障并加速炎性脱髓鞘的过程,在起病过程中承担重要作用。研究表明,METs释放会破坏血脑屏障完整性,导致免疫细胞和炎性介质进入中枢神经系统,加剧炎症反应和脱髓鞘病变。METs还能直接对神经元及其髓鞘产生毒性作用,加速髓鞘脱失与神经损伤。
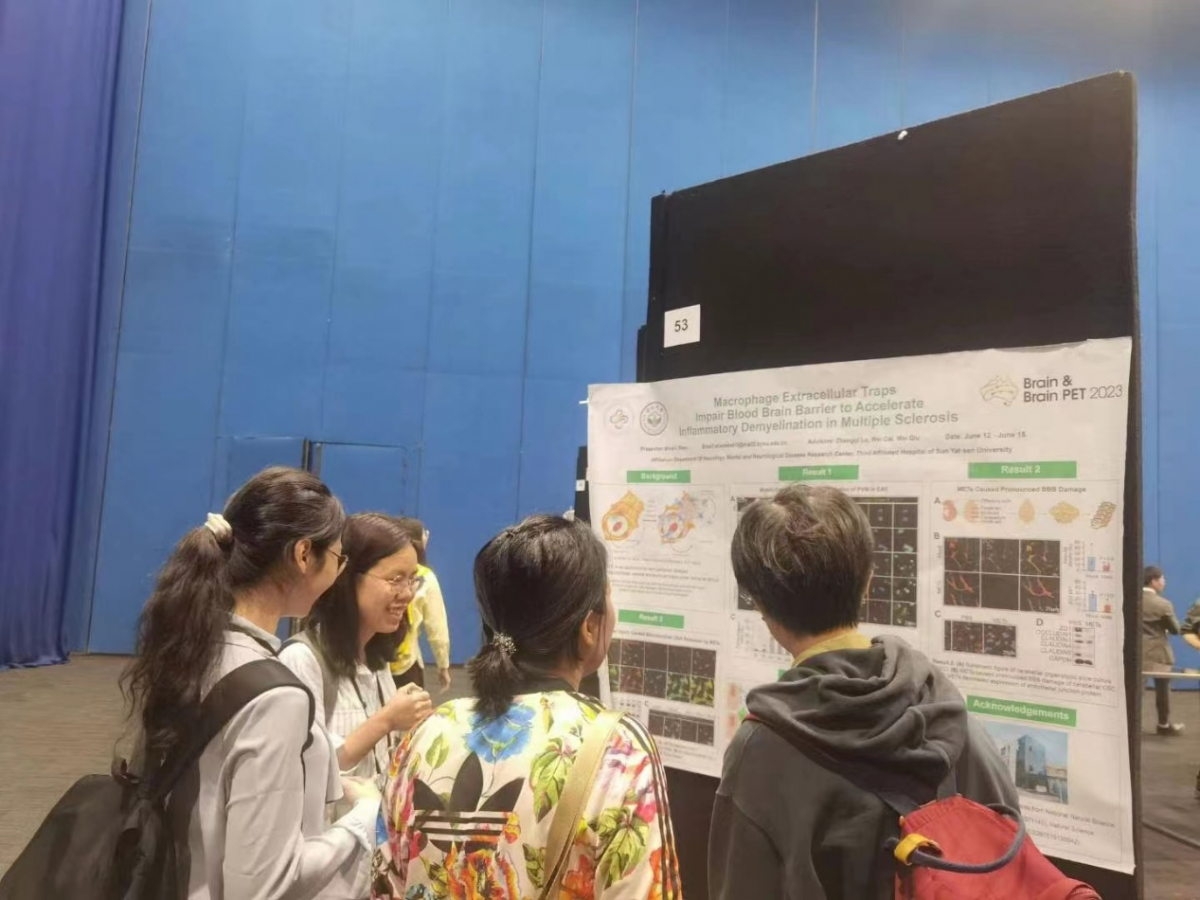
图2:沈施施博士后进行壁报展示
神经内科苏晓桃博士作题为《Bone Marrow-darived Mesonchymal Stem Cell Ameliorates Post-stroke Enterobacterial Translocation through Liver-Gut Axis》的分享。肠道菌群移位是导致急性缺血性卒中患者致死性感染的主要诱因。相当多的证据表明,间充质干细胞(Mesenchymal Stem Cell, MSC)有效地改善中风预后。脑病中心神经血管免疫团队报道,中风后脑缺血造成机体糖皮质激素水平反应性升高,从而引起杯状细胞粘蛋白的生产减少,进而肠道黏液层变薄,机体发生显著的肠道菌群易位。骨髓间充质干细胞(BM-MSC)的移植恢复了粘蛋白分泌能力并维持了黏液层厚度,进而保持了肠道菌群的平衡,防止了细菌入侵。机制层面,转移的BM-MSCs定位于肝脏中,并增强肝细胞的PPARγ信号通路,使得HSD11B2和SRD5A1的表达增加,而HSD11B1的水平下调;这些改变促进了糖皮质激素的分解代谢,进而恢复粘蛋白生成。团队研究结果表明,MSC转移改善卒中后肠道屏障完整性的破坏,并通过增强肝脏对糖皮质激素的代谢而抑制肠道细菌易位。

图3:苏晓桃博士进行大会发言
神经内科黄惠蓬博士作题为《Anxiety Exacerbates Damage of Neurovascular Unit in Cerebral Amyloid Angiopathy through Induction of Neutrophil Extracellular Traps》的专题分享。中性粒细胞网捕死亡(NETosis)是一种强有力的杀伤手段,研究表明,淀粉样蛋白能够引起中性粒细胞发生网捕死亡。脑病中心神经血管免疫团队发现,脑血管淀粉样病(Cerebral Amyloid Angiopathy,CAA)小鼠模型脑中中性粒细胞浸润增加,并以NETosis的形式参与脑血管淀粉样变的进展;抑制中性粒细胞向脑部趋化或者抑制其网捕死亡的发生能够暂缓淀粉样蛋白的沉积并减少血管紧密连接蛋白丢失和髓鞘损失,最终改善疾病动物模型。

图4:黄惠蓬博士进行大会发言
神经内科胡梦颜博士作题为《Senile Perivascular Macrophage Promotes Microglial Senescence through Large Extracellular Vesicles in CAA》的专题分享。血管周围巨噬细胞(Perivascular Macrophages, PVM)首先遭遇沉积蛋白Aβ1-40(Aβ40),然而PVM受Aβ40刺激后传递给小胶质细胞的信息尚不明确。脑病中心神经血管免疫团队发现,PVM遇到Aβ40会产生复制性衰老并释放CD5L负载的胞外小体,其通过激活CD16-ARF信号传导进而促进小胶质细胞衰老。衰老的小胶质细胞清除功能受损,将加速CAA的发病和进展。阻断CD5L和CD16之间的相互作用是对抗CAA中小胶质细胞衰老的一种潜在且充满前景的治疗策略。

图5:胡梦颜博士发言
神经内科李春仪博士作题为《NOTCH3 Mutation Causes Glymphatic Dysfunction and Brain Presenility in CADASIL》的专题分享。CADASIL是由NOTCH3突变引起的最常见的单基因遗传性脑小血管病,既往已有报道CADASIL患者脑部有血管周围间隙增大和脑萎缩改变,但具体机制不明。脑病中心神经血管免疫团队发现,CADASIL大脑星形胶质细胞中AQP4的表达减少,导致CADASIL小鼠脑类淋巴系统的流入和流出功能障碍;进一步发现,AQP4的下调是由于NOTCH3突变导致RUNX1-cMYB信号通路下调,而该通路参与调节AQP4的转录。通过基于AAV的基因治疗增强星形胶质细胞中AQP4的表达,可以恢复CADASIL小鼠的脑类淋巴系统功能并缓解脑早衰。

图6:李春仪博士发言
神经内科助理研究员王施思作题为《Agomelatine Promotes Differentiation of Oligodendrocyte Precursor Cells and Preserves White Matter Integrity after Cerebral Ischemic Stroke》的专题分享。急性缺血性脑卒中(Acute Ischemic Stroke, AIS)是由于脑部供血中断引发的神经细胞死亡,其亦会损害白质,进而影响神经元间正常通信。少突胶质前体细胞在急性脑梗死后可分化为少突胶质细胞继而促进神经损伤的修复与再生。阿戈美拉汀(Agomelatine)是一种用于治疗抑郁症和其他心理健康问题的药物,其在白质损伤中的作用尚未报道。脑病中心神经血管免疫团队研究表明,Agomelatine在脑缺血性中风后有促进少突胶质前体细胞分化和保护白质完整性的作用。

图7:王施思助理研究员发言
神经内科刘宇欣硕士在大会上发言表示,近些年来,AIS的血管内介入治疗取得很大进展,目前学界和临床界倾向于打破治疗时间窗的6h黄金界限,逐步计划将时间窗后推。为配合好这一新理念,使用有效药物可保护缺血半暗带内各种细胞成分,改善血管再通治疗的疗效。研究表明,褪黑素可以保护脑血管内皮细胞(BVECs)免受缺血-再灌注损伤。脑病中心神经血管免疫团队发现,褪黑素通过减轻内质网应激和清除顽固性应激颗粒对缺血-延迟再灌注后的BVECs发挥双时相保护作用。前期的研究成果支持褪黑素是一种可行的治疗方法,可以辅助延长AIS取栓治疗的时间窗。

图8:刘宇欣硕士进行大会发言
神经内科康新梅博士后以壁报形式展示了急性缺血性脑卒中的相关研究成果。急性缺血性脑卒中是一种常见的神经血管疾病,其主要特征为脑部缺血导致的神经元损伤。脑病中心神经血管免疫团队发现,胸腺肽α1(Thymosin alpha 1,Tα1)可以通过上调觉醒素受体1(Hypocretin Receptor 1,HCRTR1)来改善急性缺血性脑卒中的预后,促进神经元存活。这为开发Tα1作为治疗急性缺血性脑卒中的潜在药物提供了科学依据,并为进一步研究脑卒中发病机制和治疗提供了新的方向。
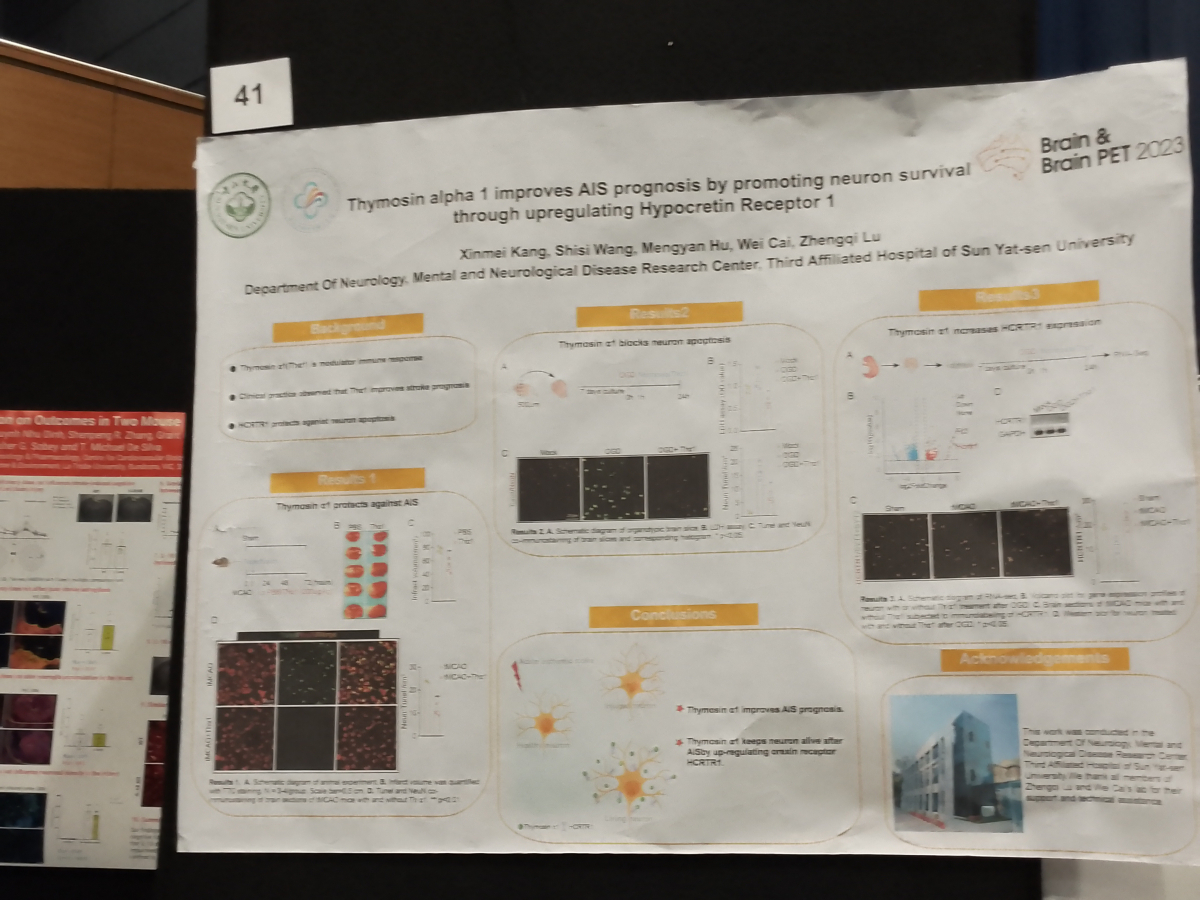
图9:康新梅博士后进行壁报展示
我院脑病中心常务副主任陆正齐教授表示,神经血管免疫团队所展示的新技术和新发现,其研究重点是探索巨噬细胞在脑血管疾病中的作用。研究团队通过蛋白质组学与分子模拟技术揭示了巨噬细胞与脑淀粉样血管病之间的重要相互作用机制,为开发脑淀粉样血管病治疗方案提供了创新且有可行性的思路;通过多种实验手段表明阿戈美拉汀是临床实践中有待发掘的治疗方法,可在卒中后促进神经功能恢复。这些研究成果突破性地为神经血管免疫领域的深入研究和临床转化提供了新的思路和策略。团队的相关工作为探索脑血管疾病的发病机制和治疗方法提供了宝贵的贡献。
我院脑病中心办公室主任邱伟表示,中山大学附属第三医院脑病中心神经血管免疫团队在2023年的Brain & Brain PET会议上展示了丰硕的研究成果,包括7项口头发言和2项壁报交流。这些研究成果覆盖了神经血管免疫领域的基础研究和临床转化研究。其中,通过多维度筛选发现巨噬细胞胞外网捕并加速炎性脱髓鞘的机制,探索巨噬细胞在MS发病中的重要作用;通过搭建干细胞治疗与多组学分析平台,发挥多学科团队协助力量,系统钻研神经血管免疫疾病及其相关并发症,创见性研究干细胞治疗急性脑梗死中菌群转位的分子机制;基于AAV的基因治疗增强星形胶质细胞中AQP4的表达,恢复CADASIL小鼠的脑类淋巴系统功能并缓解脑早衰。这些创新研究为神经血管免疫患者的综合治疗和精准管理模式提供了理论支撑。同时,团队重视研究生培养,通过为他们提供发展的舞台和机遇,促使研究生在神经血管免疫领域的研究中获得成长和成功。






